Попередня сторінка: 9. Egyirányú és megfordítható kémiai reakciók
Наступна сторінка: 11. A reakciótermék relatív hozama
E téma tananyaga segít nektek:
megvilágítani, milyen változások történnek a megfordítható reakciókban az idő múlásával; ismereteket szerezni a kémiai egyensúlyról; meghatározni a kémiai egyensúly elmozdulásának irányát bizonyos külső hatások esetén.
Kémiai egyensúly. Már tudjátok, hogy az egyik tényező, amitől függ a reakció sebessége -a kiindulási anyagok koncentrációja. Nagyobb koncentráció esetén nagyobb a reakció sebessége.
Miért változik a reakció sebessége az anyagok koncentrációjától?
Vizsgáljuk meg az A és а Б anyagok vizes oldatai kölcsönhatásának folyamatát, melynek során C reakciótermék keletkezik. Tételezzük fel, hogy mindegyik anyag molekulából áll. A reakció körülményei olyanok, hogy a folyamat visszafordítható:

Az A és а Б anyag oldatainak összeöntésével reagálni kezdenek az anyagok. A reakció előrehaladtával fogynak a kiindulási anyagok, kisebb lesz a koncentrációjuk, ezzel együtt csökken a reakciósebesség.
Eközben a reakciótermék, a C anyag koncentrációja megnövekedik, vagyis a visszaalakulási folyamat sebessége is nő. Egy idő múlva a két folyamat sebessége egyenlővé válik (14. ábra); amennyi C anyag képződik az A és a B anyag egyesülése során egységnyi idő alatt, ugyanannyi C anyag bomlik fel A és B anyagokra azonos időegység alatt A továbbiakban mindkét reakció sebessége, valamint a reakciótermékek és a kiindulási anyagok koncentrációja változatlan marad.
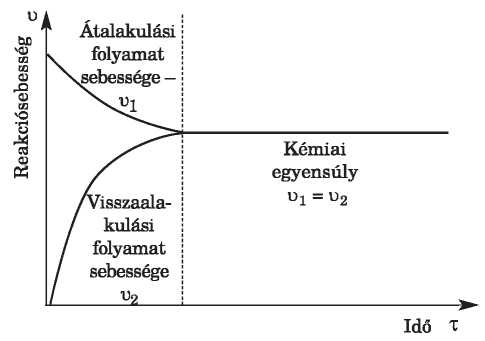
14. ábra
A megfordítható kémiai reakciók sebességének időbeli változása
A reagensek keverékének azt az állapotát, amelynél az átalakulási (közvetlen) és a visszaalakulási (fordított) reakciók sebessége azonos, kémiai egyensúlynak nevezzük.
Egyes esetekben a kémiai egyensúly azonnal létrejön (amikor a közvetlen és a fordított reakciók sebessége nagyon magas), másokban viszont csak hosszú idő után (amikor mindkét reakció sebessége lassú).
Ha figyelemmel kísérjük a reverzibilis reakció lefolyását, a kémiai egyensúly beállása után szemmel láthatóan nem történik változás (nem változik az oldat színe vagy a csapadék mennyisége). Ez azonban nem azt jelenti, hogy a kémiai reakció befejeződött. Valójában állandó át- és vissza-alakulás történik, egységnyi idő alatt ugyanannyi termék keletkezik, mint amennyi visszaalakul. Ezért az előálló egyensúlyi állapotot dinamikus egyensúlynak kell tekinteni, hiszen a kémiai reakciók továbbra is folytatódnak.
Az egyensúlyi állapot befolyásolása. A számos kémiai kísérlet és az ipari gyártás célja is az, hogy minél több reakcióterméket nyerjünk. Nagyon sok kémiai folyamat reverzibilis (megfordítható), viszont van rá lehetőség, hogy a számunkra kívánatos irányba tudjuk eltolni az egyensúlyt. Vizsgáljuk meg ezt az A és a B anyagok kölcsönhatásának példáján, amikor Canyag képződik (mindegyik anyag oldat vagy gáz - vagyis a kialakuló keverék homogén rendszer):
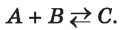
Ha a kiindulási anyagok közül az egyiknek, mondjuk az A anyagnak megnöveljük a koncentrációját (hozzáadunk a keverékhez), akkor megnöveljük az átalakulási folyamat (egyenes reakció) sebességét, mivel az a folyamat gyorsul fel, ahol nagyobb a koncentráció, addig, amíg le nem csökken az A és a B anyagok mennyisége, ami a reakciósebesség csökkenéséhez vezet. A C anyag mennyisége viszont több lesz, így a visszaalakulás is meggyorsul. Egy ponton mindkét reakciósebesség azonos lesz, és egy újabb egyensúlyi állapot képződik. Az új egyensúlyi rendszerben az A és a Canyag koncentrációja nagyobb, a B anyagé pedig kisebb lesz, mint a beavatkozásunk előtt.
Hemy-Louis Le Chatelier francia tudós fogalmazta meg a kémiai egyensúly befolyásolásának szabályait (a legkisebb kényszer elvej.
ha valamely rendszert (anyagok keverékének halmazát) egyensúlyi állapotában megzavarnak (megváltoztatják a reagáló anyagok vagy termékek koncentrációját, a hőmérsékletet vagy a nyomást), a rendszer úgy állítja helyre az egyensúlyát, hogy annak a folyamatnak lesz nagyobb a sebessége, amelyik a zavaró hatást csökkenteni igyekszik.
Az imént megvizsgált folyamatban a kiindulási anyag koncentrációját növeltük: az egyensúly a felső nyíl irányába tolódott el, ahol a reagens mennyisége csökken.
Milyen irányba tolódik el a kémiai egyensúly az

reakcióban, ha csökkentjük az A
anyag koncentrációját a keverékben?

Henry-Louis Le Chatelier (1850—1936)
Híres francia fizikus, kémikus, metallurgiai szaktekintély, a Randa Tudományos Akadémia tagja, más országok tudományos társulatainak, a londoni Royd Sodety tagja. A kémiai egyensúly a külső tényezőktől függő eltolódásának általános elvét fogalmazta meg (1884%
Kísérletileg megerősítette az okiatok és a fémötvözetek közötti analógiát Mikroszkópot készíteti: az átlátszatlan szilárd anyagok, különösen a femek tanulmányozására.
A magas hőmérsékletek mérésére kifejleszteti egy elektromos hőmérőt, optikai píroméiért alkotott, amely a hőforrás fényének elemzésével ugyancsak magas hőmérsékletek mérésére alkalmas.
Ha csökkentjük a termék koncentrációját (ha a terméket folyamatosan elvonjuk az egyensúlyi élegyből), a kémiai egyensúly a termékképződés irányába tolódik eL Ahhoz, hogy több tennék (észter) keletkezzen az észterképződés során,
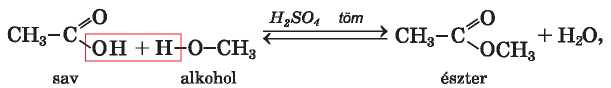
a reaktánsok elegyét melegítik, hogy az egyenes reakció egyik illékony termékét (az észtert vagy a vizet) eltávolítsák. Ezzel a módszerrel gyakorlatilag teljes átalakítást tudnak elérni. A másik lehetőség, hogy a kiindulási anyagok közül az egyiket, a karbonsavat vagy az alkoholt, a sztöchiometriai mennyiséghez képest nagy
Vizsgáljuk meg, hogyan hat a hőmérséklet változása az egyensúlyi állapotra. Tegyük fel, hogy az A és а Б anyag közötti reakció exoterm, vagyis hőkiválással járó folyamat:

Ha az egyensúlyi elegy hőmérsékletét növeljük, Le Chatelier elve alapján az endoterm reakció irányába, vagyis a C anyag bomlása felé tolódik el az egyensúly.
Ebben az esetben az energia nem halmozódik fel, hanem elhasználódik. Egy kis idő elteltével új kémiai egyensúly alakul ki: az A és a B anyagok tömege nagyobb, a C anyag tömege kisebb lesz. Vagyis a hőmérséklet növelésével a kémiai egyensúly az endo-term reakció irányába, a hőmérséklet csökkentésével az exoterm folyamat irányába tolódik el.
A hőmérséklet növelésével megnövekszik vagy csökken a termék tömege a
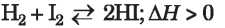
folyamatban?
Végezzünk el még egy elméleti kísérletet. Tegyük fel, hogy a
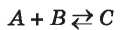
reverzibilis folyamatban minden anyag gázhalmazállapotú. Az egyenletből látható, hogy I mol A gáz reagál I mol B gázzal (vagyis összesen 2 mól anyag) és 1 mól C gáz keletkezik. Más szóval, minden két térfogatnyi reagensből egy térfogat reakciótermék képződik. Növeljük meg a nyomást az egyensúlyi elegyben. Ahhoz, hogy a hatás csökkenjen, az egyensúly jobbra tolódik el, annak a reakciónak az irányába, amely térfogatcsökkenést eredményez; ekkor ugyanis csökken a nyomás is.
A nyomásváltozás nincs hatással az olyan egyensúlyi rendszerekre, ahol a gázhalmazállapotú anyagok reakcióját nem kíséri mólszám-változás.
Vajon hatással van-e a nyomás változása a
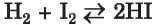
reakció egyensúlyára (minden
reaktáns gáznemű)?
GYAKORLAT. Elemezzétek a külső körülmények hatását (hőmérséklet, nyomás) az

megfor
dítható reakció egyensúlyi elegyében.
Megoldás
A feladat feltétele szerint az ammónia egyszerű anyagokból történő képződése hő felszabadulásával jár. A legkisebb kényszer elve alapján a kémiai egyensúly a hőmérséklet növelésekor hőelnyelő
reakció irányába tolódik el, vagyis az ammónia bomlásának irányába.
Az ammóniaszintézisnél az egyensúlyi elegyben minden anyag gázhalmazállapotú. Egy térfogategységnyi nitrogéngáz reagál három térfogategységnyi hidrogéngázzal (összesen 4 térfogategységnyi gázelegy), eközben 2 térfogategységnyi ammónia keletkezik. A nyomás növelését csak úgy tudjuk kompenzálni, ha az egyensúly a térfogatcsökkenéssel járó irányba tolódik el (ekkor csökken a nyomás is), vagyis az ammóniaképződés irányába.
Vannak megfordítható reakciók, melyeknél katalizátort alkalmaznak. A tapasztalat azt mutatja, hogy a katalizátor felgyorsítja mind az egyenes (közvetlen), mind a fordított reakciókat, vagyis az egyensúlyi helyzet elérését gyorsítja meg, de nem befolyásolja az eltolódását.
Kémiai egyensúlyok vizes oldatokban. A savak elektrolitikus disszociációja, számos só vízzel való kölcsönhatása (12. §), több más oldatokban lejátszódó reakció reverzibilis folyamat. Rájuk is érvényes Le Chatelier elve. így például, ha az ecetsav oldatához
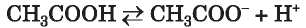
saját sóját adagoljuk (például kálium-acetátot CH3COOK), amely acetát-iont CH3COO-, tartalmaz, az acetát-ion koncentrációjának megnövelésével balra tolódik el a kémiai egyensúly: abba az irányba, ahol az ecetsav molekulája van (a disszociáció-fok csökken).
ÖSSZEFOGLALÁS
A megfordítható reakció során az egyenes (képződési) reakció sebessége csökken, a fordított (visz-szaalakulási) reakció sebessége pedig nő. Amikor egy adott pillanatban mindkét reakció sebessége azonos lesz, kémiai egyensúly alakul kL A kémiai reakciók egyensúlyát befolyásolni lehet a reagáló anyagok vagy termékek koncentrációj ának megváltoztatásával, a hőmérséklet vagy a nyomás változtatásával. Ha egyensúlyban lévő rendszert külső hatás ér, az egyensúly olyan irányba tolódik el, amelyben a rendszer a külső hatást csökkenteni tudja (a Le Chatelier-elv).
75. Hogyan csoportosítják a reakciókat a folyamat iránya szerint?
76. Mit értünk kémiai egyensúlyon? Miért nevezik dinamikusnak?
77. Melyek azok a tényezők, amelyekkel egy kémiai reakció egyensúlyát befolyásolhatjuk? Vajon a hőmérséklet változásával változik-e mindig az egyensúlyi állapot? A feleletet indokoljátok.
78. Történnek-e változások az alábbi egyensúlyi rendszerekben (minden reaktáns gáznemű), ha melegítjük a gázelegyet, illetve ha csökkentjük a nyomást:
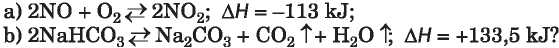
Ha igen, milyen irányba tolódik el az egyensúly? 79. Hogyan kell megváltoztatni a hőmérsékletet a

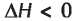
reakciónál, hogy a bomlás irányába tolódjon el a kémiai egyensúly? A nyomásváltozás befolyásolja-e az egyensúlyt?
80. Zárt rendszerben meghatározott hőmérsékleten a
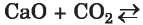
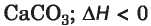
megfordítható folyamatnál beáll a kémiai egyensúly. Vajon megváltozik-e az egyensúly, ha a rendszert nyitottá tesszük, de a hőmérsékletet nem változtatjuk? Pozitív válasz esetén határozzátok meg, milyen irányú változás történik. Válaszotokat indokoljátok.
ÉRDEKLŐDÖK SZÁMÁRA
Ukrán származású Nobel-díjas
A kémiai reakciók lefolyása sajátosságainak vizsgálata a kémiatudomány egyik fontos irányzata. Ezen a területen folytatott munkásságáért és kifejlesztett elméletéért 1981-ben Nobel-díjat kapott az amerikai Roald Hoffmann (15. ábra):

15. ábra
Roald
Hoffmann
Roald Hoffmann 1938-ban született Zolocsiv városában (a mai Lviv megye területén). A megszállás alatt családjával náci táborba
Került. Sikerült családjának elmenekülni a táborból. 1949-ben az Egyesült Államokba költöztek.
Roald Hofftnann professzor éveken keresztül együttműködött az ukrán tudósokkal. Többször meglátogatta Ukrajnát. 80. születésnapja alkalmából a tudós videó-üzenetet küldött az ukrán nép számára, amely a következőket tartalmazta: „A biztonságos, szabad, demokratikus ukrán állam felé vezető út hosszú, de elérhető.”
2017-ben az ukrán posta R. Hoffmann érdemeinek méltatására .postai bélyeget adott ki honfitársunk arcképével.
Ez a tankönyv anyaga Kémia a 11. osztály számára Pavlo Popéi
Наступна сторінка: 11. A reakciótermék relatív hozama